
文章图片

文章图片
骨关节炎(Osteoarthritis , OA)是一种由多种因素引起关节软骨纤维化、皲裂、溃疡、脱失的退行性疾病 , 主要以关节疼痛为主要症状 。 OA好发于中老年人群 , 发病率高 , 65岁以上的人群50%以上为OA患者 。
关节软骨的自我再生能力有限 。 目前治疗骨关节炎患者的软骨缺损主要是保守治疗 , 包括常规药物治疗和常规手术治疗 。 手术治疗适用于骨关节炎中小面积软骨缺损修复 , 治疗结果不理想 , 所修复的软骨会在数年内退变 。
干细胞的使用已成为再生医学领域的研究热点 。 其中 , 间充质干细胞具有低免疫原性和强扩增能力 , 能用于多种疾病的治疗 。
干细胞治疗骨性关节炎机制免疫调节作用机制:包括分泌免疫 抑制性细胞因子配体和受体以及直接调节免疫细胞 分化来调节免疫反应 。 首先 , 炎症因子干扰素γ、 肿瘤坏死因子(TNF)α和白介素(IL)1β等能刺激MSC表达免疫抑制剂、 程序性细胞死亡配体1(PD-L1)和PD- L2以及下调免疫球蛋白样转录物受体 , 从而抑制炎症反应 。 其次 , MSC还可通过其表达的免疫调节因子来调节多种类型的免疫细胞 , 从而达到抗炎的目的 。
骨与软骨修复:MSC的分化作用与旁分泌作用是骨与软骨修复的主要作用机制 。 MSC 微环境在其中起到了重要作用 , 主要指分子及细胞层面的基质细胞、微循环、信号转导通路等多方面多层次组成的MSC生存环境 。
旁分泌作用:近年来的研究发现 , MSC是通过旁分泌作用特别是外泌体调节微环境来促进其自身修复的 , 而非简单地进行新旧细胞的更替 。 外泌体通过对多条信号通路及细胞因子的调控(如蛋白激酶B、细胞外调节蛋白激酶、Wnt信号通路、微小RNA 等)来抑制软骨细胞凋亡、促进损伤软骨细胞修复及促进软骨细胞增殖 。
基础研究lisa等人为了研究诱导多能干细胞来源间充质干细胞(iPSC-MSCs)对大鼠骨关节炎(OA)的治疗作用 。
将50只大鼠OA模型分为模型组 , iPSC-MSCs组、人脐带来源间充质干细胞( hUC-MSCs)组、玻璃酸钠(HA)阳性对照组 , 另设假手术组作为对照 , 每组10只 。 除HA组动物多次给药(每周1次 , 共给药5次)外 , 其它各组均单次给药 , 每次每只动物在术侧关节腔注射50 μL药物iPSC-MSCs和hUC-MSCs假手术组和模型组同法给予生理盐水 。
随访五周发现
结果:iPSC-MSCs和hUC-MSCs给药均可显著降低膝关节面Pelletier评分、关节直径和病理Mankin评分 , 改善关节腔结构 , 降低X线评分和关节肿胀 。
结论:关节腔注射iPSC-MSCs可显著改善OA大鼠关节病理 , 具有明显的软骨保护作用 。
临床案例研究人员对60例骨性关节炎进行随机分组 , 对照组中 , 男18例 , 女12例 , 年龄40~ 69岁 , 平均( 48.27±4.32 )岁 , 病程1~14年 , 平均(5.6±0.3)年;观察组中 , 男17例 ,女13例 , 年龄41~70岁 , 平均(48.71±4.52)岁 , 病程1~13年 , 平均(5.4±0.4)年 。
方法:对照组采取常规治疗方案 , 观察组患者采取自体脂肪干细胞治疗 。 在无菌环境下取人腹部脂肪组织 , 然后将其进行定向诱导分化 , 对患者进行注射 。
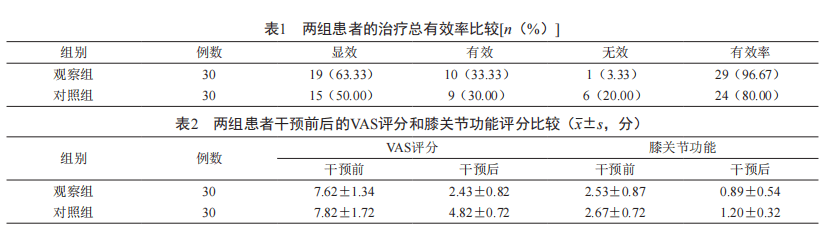
评价指标:对两组患者的治疗效果进行观察 , 以显效、有效、无效为准 。 同时 , 对两组患者干预前后的VAS评分和膝关节功能状况进行统计 。
结果:从实验结果上看 , 两组治疗有效率比较差异明显 , 差异有统计学意义(P<0.05) , 且以观察组占优;在干预前 , 两组的膝关节功能活动状况与VAS评分比较无差异 , 差异无统计学意义(P>0.05);在 干预后 , 两组的膝关节功能活动状况与VAS评分相较 差异明显 , 差异有统计学意义(P<0.05) , 且观察组占优 。 具体数据参见表1、表2 。
综上所述 , 对骨性关节炎采取自体脂肪干细胞治疗的临床效果显著 , 值得推广 。
【叶面肥|临床研究,干细胞疗法对骨性关节炎应用与进展】相信随着干细胞技术的发展 , 希望干细胞疗法在临床应用上早日为骨性关节炎患者带来福音
- 显微镜|肥皂泡破裂时温度达2万℃,高过太阳温度,为何不烫?
- |又一项造福人类的研究问世!我国科研团队发现减肥新途径:躺平就行
- Nature|重大突破!暨大研究团队发现减肥新途径,登上《Nature》正刊
- 多发性硬化症|在研干细胞新药完成首例多发性硬化症患者用药,欲知临床疗效看这
- 高通骁龙|终于把骁龙养肥了,都要改标识,脱离高通成为独立品牌了
- 抗体|科技日报:我国新冠特效药“候选种子”三期临床揭盲
- 抗体|零死亡!我国新冠特效药“候选种子”三期临床已揭盲
- 新型冠状肺炎|达安科普:新冠有效药进入临床阶段,新冠核酸快速检测可以丢弃?
- |NASH在研新药CRV431,非临床HCC小鼠模型,观察到有益活性
- |神经鞘瘤会复发吗?
