按关键词阅读:
记录后 , 对获取的图像进行对比度受限的自适应直方图平衡(CLAHE)46 , 通过频域47中的定向空间滤波去除条纹伪影 , 以及对最终清晰度进行锐化掩盖 。 我们发现 , 按此处理步骤 , 可以显着提高对比度 。 为了通过CLAHE获得最佳结果 , 图像中的灰度级数应尽可能高(例如 , 对应于65,535灰度级的16位) , 因为该算法会将不明显的小亮度差异转换为人眼可以很好感知的较大差异 。
文章图片
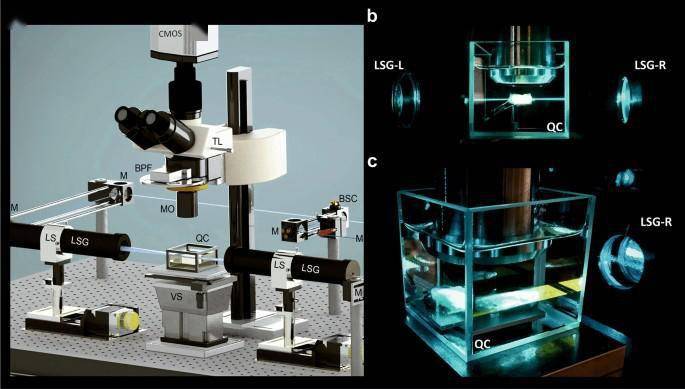
(a)超显微设置:用于荧光激发的蓝宝石激光器单元(未显示) , 分束器立方(BSC) , 45度银镜(M) , 两个光片发生器单元(LSG) , 两个可移动的线性平台(LS)沿光束传播轴(z)的LSG单元 , 用于将光片的中心叠加在生物样品的中心;计算机控制的平台 , 用于将样品垂直移动通过光片(VS);石英容器(QC), 其中装有成像介质(DBE) 。 检测单元包括配备有用于补偿折射率失配的调制器(MO)的×2 , ×4或×16物镜 , 配备有带通滤光片(BPF)轮的管状透镜(TL)和CMOS相机 。 (b , c)以×2放大率记录癌症样品 。

文章图片
由于所有应用的图像处理步骤都在2D图像上进行操作 , 因此它们在计算上不会耗费大量成本 , 例如3D反卷积方法(需要输入三维数据) 。 因此 , 整个记录处理链基本上可以在记录过程中使用最新的多处理器计算机实时地执行 。
3D重建
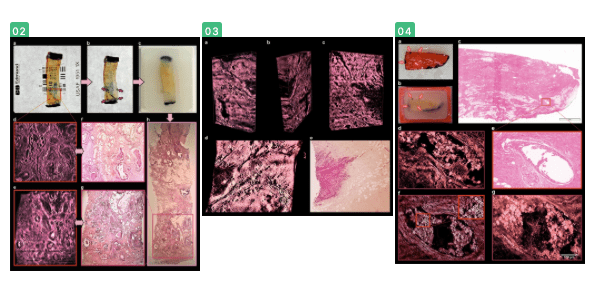
【组织|【新技术】3D肿瘤显微镜可对肿瘤组织进行三维角度分析,简化肿瘤诊断!价格便宜易操作!】预处理后 , 使用可视化软件AMIRA 6.7(德国Thermofisher)三维重建了600–2,000张图像的堆栈 。 由于肿瘤记录是单色的 , 因此必须通过其特征性自发荧光强度来区分不同类型的组织(图 1 d1 , e1 , f1) 。 我们发现最高的自发荧光强度对应于红细胞和微钙化 , 血管结构和胶原纤维 。 因此 , 血管结构和胶原纤维用2×或4×放大倍数(图变得可见 1 D2 , E2) , 红细胞(图 1 F 2 , 4 G)可以使用16×放大率被识别 。 核(放大16倍)(图 4d , f)和脂肪细胞(放大2倍或4倍)(图2 d , e , 3 d)由于自身荧光较低而显得较暗 。
文章图片
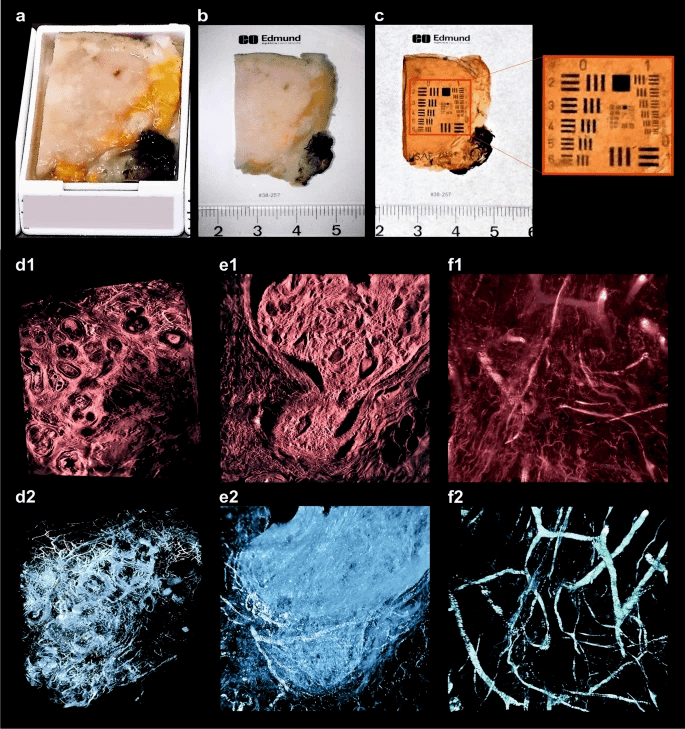
3D组织病理学应用于人类乳腺肿瘤 。 突出显示与癌症相关的组织结构 。 (a , b)未清除的乳房组织标本 。 (c)化学组织清除后的同一标本 。 (d – f)标本的3D重建的代表性图像 。 (d1)以×2放大率记录的DCIS样品的选择平面 。 (d2)具有突出显示的血管的相同3D重建 。 (e1)以×16放大率记录的乳腺癌标本的3D重建选择平面 。 (e2)相同的3D重建 , 突出显示了血管和有丝分裂活动部位 。 (f1)以×16放大倍数记录的乳腺癌样品的3D重建 。 (f2)分别观察同一样本的血管(参见补充材料中图4的电影 ) 。
文章图片
为了简化人类视觉对相关组织结构的检测和识别 , 我们开发了几种颜色图 , 可将亮度差异转换为颜色差异 。 我们还执行了基于强度的阈值分割 , 以突出显示3D重建中与诊断相关的结构 。 我们可以证明这可以可视化某些癌症标志 。
病理学的革命
Hans-Ulrich Dodt 说:“我们坚信这种方法将彻底改变病理学 。 在比以前更少的时间内 , 可以实现更高的检查可靠性 。 此外 , 新的3D方法还为将来的癌症发展提供全新的见解 。 ”
3D肿瘤显微镜的使用使病理学工作变得更加容易 。 Hans-Ulrich Dodt 表示:“病理学家将不再需要在显微镜下检查大量的组织切片 , 而是可以使用鼠标在图像上滚动 , 这与放射学家现在的工作方式类似 。 ” Dodt认为 , 在此过程中生成的大量图像数据也为人工智能领域带来了全新的机会 , 这样的计算机程序可以在将来加快并简化肿瘤诊断 。 ”
稿源:(健康界)
【】网址:http://www.shadafang.com/c/hn102cW0S2020.html
标题:组织|【新技术】3D肿瘤显微镜可对肿瘤组织进行三维角度分析,简化肿瘤诊断!价格便宜易操作!( 二 )
