(人民日报健康客户端)16款创新药批准上市,创下三年同期历史新高;新一轮医保谈判启动,第五轮带量采购落地;推进疾控体系改革,全国推广三明医改经验……今年上半年,我国卫健委、药监局、医保局三医领域都有哪些亮点?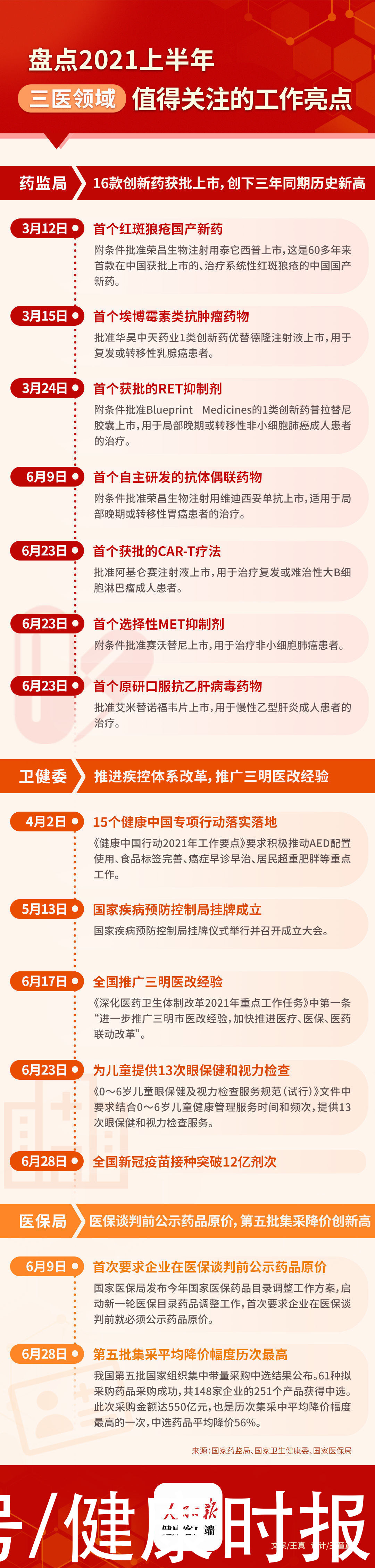
文章插图
药监局:16款创新药获批上市,创下三年同期历史新高
今年截至6月30日,国家药监局已经批准16款创新药物(不包含疫苗和中药)上市。16款药物均通过优先审评审批程序获批。
据药监局网站数据显示,2020年全年获批新药有14款,2019年全年获批新药16款。这意味着,今年上半年获批新药数量创下近三年来的同期历史新高。今年获批的16款新药中还不乏多个“首个”,临床意义重大。
· 首个红斑狼疮国产新药
3月12日,国家药监局附条件批准荣昌生物注射用泰它西普上市,与常规治疗联合,适用于在常规治疗基础上仍具有高疾病活动的活动性、自身抗体阳性的系统性红斑狼疮成年患者。泰它西普是60多年来首款在中国获批上市的、治疗系统性红斑狼疮的中国国产新药。
· 首个埃博霉素类抗肿瘤药物
3月15日,国家药监局批准华昊中天药业1类创新药优替德隆注射液上市,联合卡培他滨,用于既往接受过至少一种化疗方案的复发或转移性乳腺癌患者。该药的获批,意味着中国迎来了首个埃博霉素类抗肿瘤药物。
· 首个获批的RET抑制剂
3月24日,国家药监局附条件批准Blueprint Medicines的1类创新药普拉替尼胶囊上市,用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌成人患者的治疗。普拉替尼的获批,不仅标志着中国迎来了首个获批的RET抑制剂,也标志着基石药业迎来了首个商业化产品。
· 首个自主研发的抗体偶联药物
6月9日,国家药监局附条件批准荣昌生物注射用维迪西妥单抗上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。该药的获批,意味着中国迎来了首款由中国公司自主研发的抗体偶联药物(ADC)。
· 首个获批的CAR-T疗法
6月23日,国家药监局批准阿基仑赛注射液上市,用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发纵隔大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡性淋巴瘤转化的DLBCL。这也是首个在中国获批的CAR-T疗法。
· 首个选择性MET抑制剂
6月23日,国家药监局附条件批准赛沃替尼上市,用于治疗接受全身性治疗后疾病进展或无法接受化疗的MET外显子14跳跃突变的非小细胞肺癌患者。这也是首款在中国获批的选择性MET抑制剂。
【 淋巴瘤|医改、集采、新药上市……盘点2021年上半年三医领域值得关注的亮点】· 首个原研口服抗乙肝病毒药物
6月23日,国家药监局批准艾米替诺福韦片上市,用于慢性乙型肝炎成人患者的治疗。这是首个中国原研口服抗乙型肝炎病毒(HBV)药物。
卫健委:推进疾控体系改革,推广三明医改经验
· 15个健康中国专项行动落实落地
4月2日,健康中国行动推进委员会办公室印发《健康中国行动2021年工作要点》,要求扎实推进15个专项行动落实落地,包括积极推动AED配置使用、食品标签完善、癌症早诊早治、居民超重肥胖等重点工作。
· 国家疾病预防控制局挂牌成立
5月13日,国家疾病预防控制局挂牌仪式举行并召开成立大会。会上强调,改革完善疾病预防控制体系,将按照系统重塑、预防为主、科学防控、协调高效的原则,理顺体制机制、明确功能定位、提升专业能力,形成从中央到基层领导有力、权威高效的疾控体系,为维护人民健康和国家安全提供保障。 
文章插图
健康时报采访人员王振雅/摄
· 全国推广三明医改经验
6月17日,国务院办公厅发布《深化医药卫生体制改革2021年重点工作任务》,第一条便是“进一步推广三明市医改经验,加快推进医疗、医保、医药联动改革”。在三明市建设全国深化医改经验推广基地,加大经验推广力度。按照“腾空间、调结构、保衔接”的路径,以降药价为突破口,同步推进医疗服务价格、薪酬、医保支付等综合改革。
· 为儿童提供13次眼保健和视力检查
6月23日,国家卫生健康委印发《0~6岁儿童眼保健及视力检查服务规范(试行)》文件,要求结合0~6岁儿童健康管理服务时间和频次,为0~6岁儿童提供13次眼保健和视力检查服务。
- 大冒险|PS美服2月会免:UFC4、过山车之星、小缇娜强袭龙堡
- 2022最新漂亮早上好问候祝福语唯美冬日风景早安图片动态表情包
- 2022春节早上好动态表情图片带字祝大家春节快乐给您拜年了!
- 妇科检查|乳腺结节、增生易变癌?注意,7类女性更受乳腺癌青睐
- 骑摩托、晒基尼照,63岁奶奶改行做模特身材比少女还火辣
- 无症状感染者|新疆霍尔果斯1月26日新增1例确诊、3例无症状感染者
- 病区|新疆霍尔果斯市疫情:在院患者病情平稳、逐步好转
- 画质|《宝可梦阿尔宙斯》GS 8分:战斗爽、画质破坏沉浸感
- 水果|水果中的“全科医生”,家里要常买!每天1个,远离癌症、痴呆,6大好处找上来
- 对外|暴雪公布了一款还没定名、从未对外的生存游戏
