药物|大专生确实多过博士,君实生物回应了这些问题,却回避了另一问题( 二 )
对此 , 君实生物回应称 , 在所有不良反应发生率中 , 更受临床医生关注的是3级及以上不良反应发生率、与药物相关的严重不良反应(SAE)发生率 。
“(这一研究的)3-4 级不良反应发生率非常低 。 ”君实生物在公告中称 , 其他1-2 级(轻微)不良反应主要包括皮疹、乏力、食欲下降、 恶心、咳嗽和头晕等 。
前述某药物研发公司的研发人员告诉红星资本局 , 一般来说 , 所有药物都会有不良反应 , 说明书中都会列举出来 。 少数中药的说明书中会写“尚未知(不良反应)” 。
“目前 , 没有明文规定说‘不良反应发生率必须低于多少才能上市’ , 没有这样的警戒线 。 ”上述研发人员称 。
四川大学某药学专业研究人士向红星资本局表示 , “‘所有不良反应发生率’虽然看着高 , 但实际上同类型药物都高 。 如果不良反应大多是轻度或中度 , 对一款救命的抗癌药物来说 , 我觉得是完全可以接受的 。 ”
疑点三:礼来制药放弃了JS016S?
回应:合作一切顺利 , 停止实验不涉JS016
君实生物的招股书显示:它和中国科学院微生物研究所合作开发新型冠状病毒中和抗体——JS016 , 目前项目处于早期开发阶段 。
今年5月 , 君实生物和美国的礼来制药签署协议 , 将在中国之外对JS016开展研发活动、生产和销售的独占许可授予了礼来制药 。
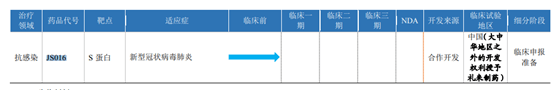
文章图片
图据其招股书 。
对此 , 该自媒体在文章中质疑 , 礼来在美国开展了两批新冠抗体临床实验 。 一批是自家研发的555抗体单用 , 一批是555+JS016的联合用药 。 其中一项涉“555”的实验已经停止临床研究 , “JS016在美国上市之路已经大概率胎死腹中了 。 ”
对此 , 君实生物回应称 , JS016在国内外的临床进展以及该项目和礼来制药的合作均一切顺利 , 不存在应披露而未披露事宜 。
“截至本回复签署日 , JS016已顺利完成中国、美国2项健康受试者I期研究 。 ”君实生物称 。
同时 , 据君实生物介绍 , 礼来制药停止的临床试验不涉及其产品 JS016 , 涉及的是礼来制药的另一个中和抗体 LY-CoV555 。
这些疑点 , 避而不谈
这对父子是外行领导内行?
红星资本局注意到 , 君实生物在对上述三大疑点进行了一一回应后 , 却对一些较为关键的指控避而不谈 。
比如 , 在该自媒体的文章中 , 零零散散地抛出了君实生物实控人父子(熊凤祥和熊俊)的背景 , 暗指其是通过人际关系使新药快速过审 。
不过 , 红星资本局在国家药品监督管局药品审评中心网站查询发现 , 特瑞普利单抗能快速获批上市 , 是由于其是“有条件获批上市” 。
有某上市制药公司的员工告诉红星资本局 , 一般来说 , 药品研发申报都要经过临床试验 , 至少是三期临床试验 , 在这之后 , 药品才能上市 。
但君实生物的是“有条件获批上市” , 根据《临床急需药品有条件批准上市的技术指南(征求意见稿)》 , 如果有新药能预防或治疗严重疾病、罕见病等 , 即可申请有条件批准上市 。
这或许是特瑞普利单抗能快速获批上市的原因 。 根据回复函内容 , 目前君实生物的相关临床试验将争取在2021年底前完成 。
哪怕上交所的问询函中提及了自媒体所说的“领导这支团队和这家公司的 , 是一对没有任何生物学科背景的父子” , 但君实生物也并未提及这对父子的情况 。
目前 , 君实生物的控股股东、实际控制人是熊凤祥和熊俊父子 。 其中 , 儿子熊俊担任董事长 。 截至今年三季度末 , 熊俊持股比例为10.01% , 熊凤祥的持股比例4.71% 。
红星资本局翻阅君实生物的财报及招股书等 , 发现:在入局君实生物以前 , 这对父子俩的履历上均没有医药相关的背景 。
- 喜利科技 128G降1000元,确实很惊喜!,OPPO不再低配高价,12
- 大学生|大专生穿“学士服”拍照引争议,他们不是大学生?看看大家的答案
- 喜利科技OPPO不再低配高价,12 128G降1000元,确实很惊喜!
- 联合国启动全球领导人小组应对抗微生物药物耐药性
- biu时尚|阿娇这身造型确实有点显老,虽然脸蛋很稚嫩,但看着却不年轻
- 公司|专访云顶新耀总裁兼首席财务官何颖:license-in是建立价值的方式之一,未来考虑做首创药物
- 大猪娱乐|金星近照曝光,坦言愿望无法完成,停止药物后越来越有“男人味”
- 新药|人民金融·创新药指数涨1.4% | 贝达药业重磅新药获批上市,多家公司布局肥胖症药物
- 人民|人民金融·创新药指数涨1.4% | 贝达药业重磅新药获批上市,多家公司布局肥胖症药物
- 谁红跟谁玩|爆红后立马签约国企?长得好看,确实能当饭吃,没读过书的丁真
