按关键词阅读:
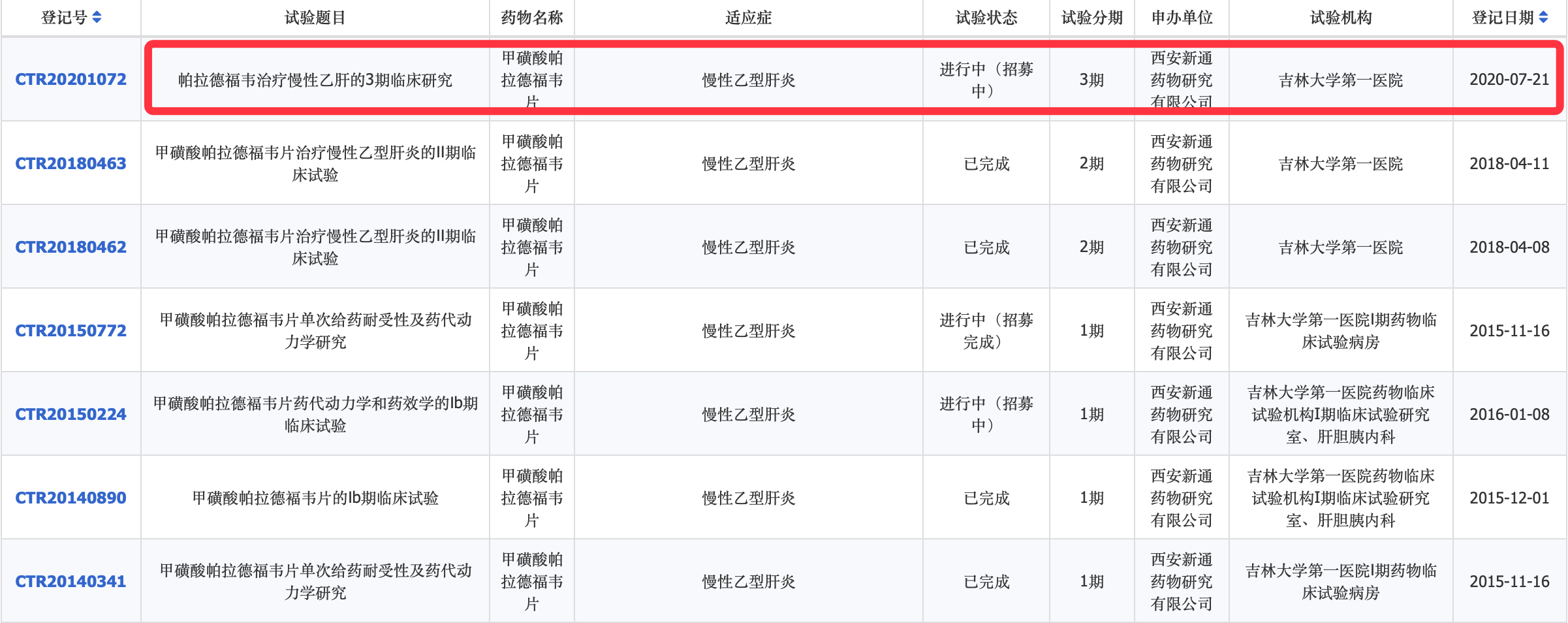
【受试者|乙肝国产在研新药帕拉德福韦,阿德福韦前药,启动III期研究】全球乙肝在研新药进入III期临床试验 , 由我国西安新通药物研究有限公司自主研发的国产乙肝在研新药甲磺酸帕拉德福韦(Pradefovir) , 2020年9月10日启动第3期临床研究 。 这也是国内乙肝创新药中 , 首个进入III期研究的在研乙肝新药(见下图:中国临床试验数据库登记信息) 。
文章图片
乙肝国产在研新药帕拉德福韦 , 阿德福韦前药 , 启动III期研究
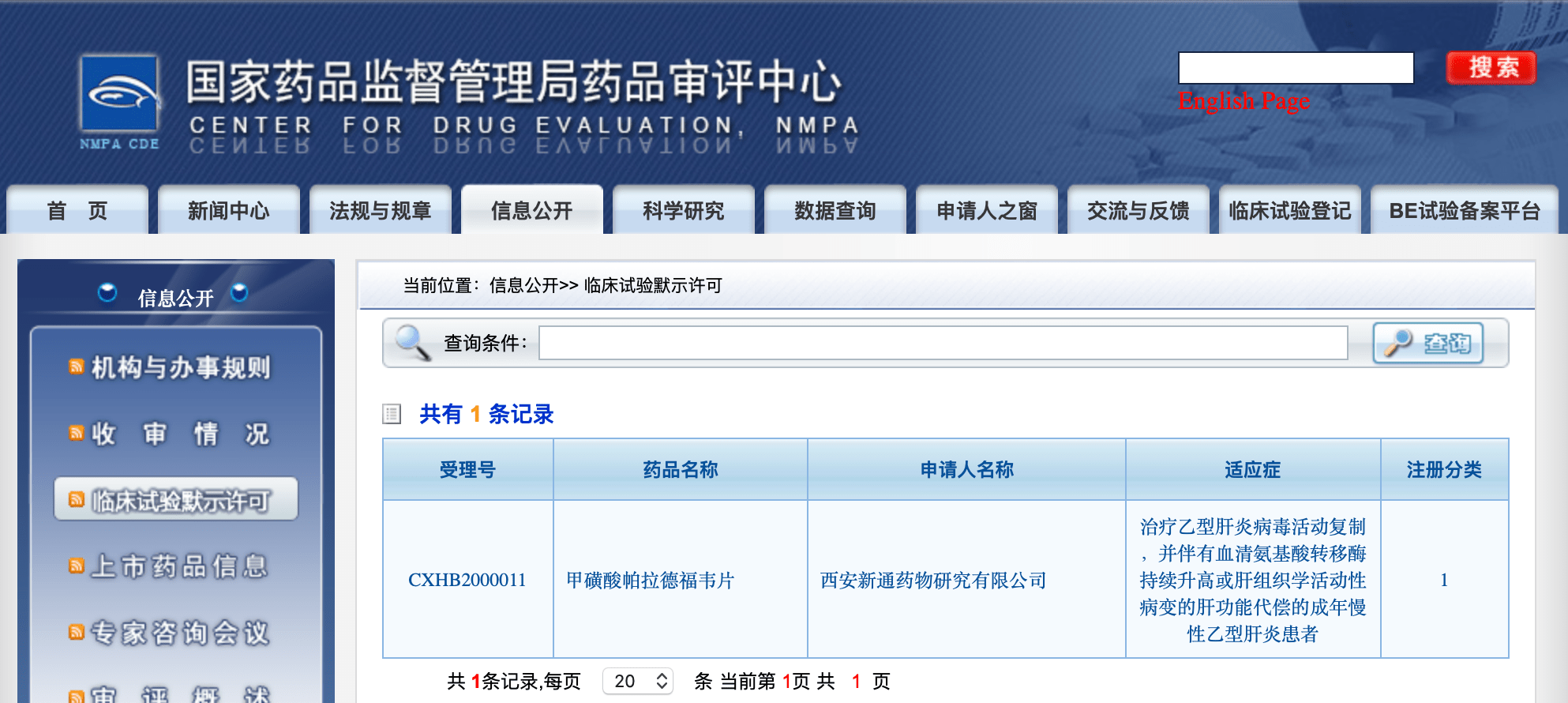
试验题目(英译):甲磺酸帕拉德福韦治疗慢性乙型肝炎病毒感染的3期研究 , 临床试验编号:NCT04543565 , 最新发布时间:2020年9月10日 , 由西安新通药物研究有限公司主办 , 试点医院:吉林大学第一医院 。 国家药品监督管理局药品审评中心显示 , 前期甲磺酸帕拉德福韦已获得临床试验默示许可 , 适应症:治疗乙型病毒活动复制 , 并伴有血清氨基酸转移酶持续升高或肝组织学活动性病变的肝功能代偿的成年慢性乙型肝炎患者 。
9月10日启动的这项乙肝在研新药III期研究 , 旨在评估Pradefovir治疗慢性乙肝患者的安全性和有效性 , 受试者按照2:1的比例随机分为Pradefovir组和TDF组 。 随机分组的治疗持续时间为96周 , 开放组为48周 。 中期分析 , 将在所有受试者完成第一个48周治疗后进行 。 本试验是在研乙肝新药Pradefovir的III期临床 , 安慰剂对照品是富马酸替诺福韦二吡呋酯(TDF) 。
文章图片
Pradefovir , 国内药品中文名称:甲磺酸帕拉德福韦片 , 它是西安新通开发的一种阿德福韦前药 , I期和II期临床试验数据表明 , 甲磺酸帕拉德福韦对抗耐药性更强 , 解决了以往核苷酸类似物(NAs)对肾脏毒性大的影响 。 II期临床数据中 , 对乙肝e抗原阳性 , HBV-DNA大于或等于20000 IU/ml、或乙肝e抗原阴性 , HBV-DNA大于或等于2000 IU/ml的未经过治疗的慢性乙肝受试者 , 使用甲磺酸帕拉德福韦30毫克、45毫克、60毫克、75毫克剂量 , 每天一次 。
给药24周后 , 受试者的HBV-DNA比较基线水平下降了5.4log、5.34log、5.33log、5.4log 。 HBV-DNA转阴(< 29IU/mL))的受试者比例是25.58%、54.55%、44.74%、56.1% 。 II期临床数据说明 , 甲磺酸帕拉德福韦总体对受试者耐受性良好 , 未发生和药物相关的严重不良事件 , 不良事件多为轻微1级 , 常见不良反应为胆碱酯酶下降、CK-MB升高、血磷下降、中性粒细胞下降 , 没有发生明确的NAs药物常见骨骼与肾脏影响 。

文章图片
甲磺酸帕拉德福韦的III期临床试验是一项随机、双盲、阳性药物平行对照、多中心、III期研究 。 符合条件的e抗原阳性或e抗原阴性的慢性乙肝患者 , 将在筛选时 , 按抗病毒治疗进行分层 , 然后按2:1比例随机分到甲磺酸帕拉德福韦组和富马酸替诺福韦二吡呋酯组 。 代偿期肝硬化患者比例不超过20% 。 将接受总共144周的抗病毒治疗 , 经过96周双盲治疗后 , 所有受试者将改用甲磺酸帕拉德福韦治疗48周 。
前48周是核心期 , 后96周是延长期 。 研究人员将对整个试验的有效性和安全性进行统计分析 。 (最后1名受试者完成48周随访后 , 进行中期分析 。 剩余受试者仍然盲法给药) 。 本试验纳入900名受试者 , 根据全球临床试验数据库登记信息:Pradefovir治疗慢性乙型肝炎病毒感染:一项多中心、双盲、随机、阳性对照的第3期研究 。 研究已于2020年9月开始 , 预计2022年10月初步完成 , 2024年12月整体III期临床试验完成 。 
稿源:(小番健康)
【】网址:http://www.shadafang.com/c/hn09149255912020.html
标题:受试者|乙肝国产在研新药帕拉德福韦,阿德福韦前药,启动III期研究
