临床|新冠中和抗体花落谁家?FDA紧急使用授权敲定,君实产品落选

文章图片
作者:小米
来源:健识局
全文2035字 , 阅读需5分钟
随着礼来新冠中和抗体的获批 , 让市场对君实生物的期待再次提高 。
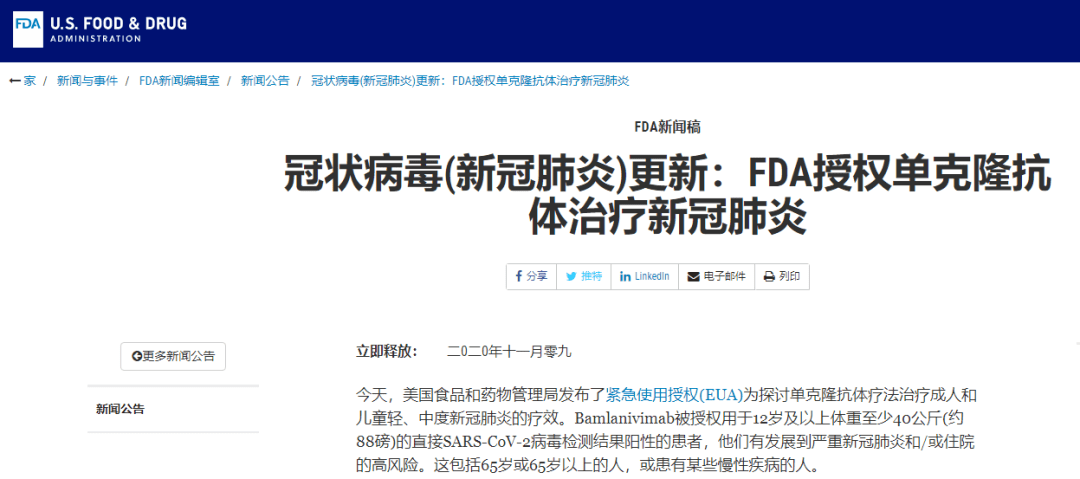
11月9日 , 美国食品药品监督管理局(以下简称“FDA”)发布紧急使用授权函称 , 新冠中和抗体bamlanivimab可用于治疗成人和儿科患者的轻度至中度新冠病毒感染 。
文章图片
不过 , 此次Bamlanivimab获得FDA批准是有严格条件的 , 患者的年龄需要在12岁以上 , 体重至少40公斤 , 并且有发展为严重感染的趋势或达到住院指标 。
尽管仍在评估这种研究性疗法的安全性和有效性 , 但FDA认为与安慰剂相比 , 在临床治疗后28天内 , Bamlanivimab降低了高风险患者的住院或急诊就诊率 。
除了这款中和抗体 , 礼来还与君实生物合作开发代号为“JS016”的新冠中和抗体 。 健识局获悉 , 礼来将于本月提交bamlanivimab与JS016联合疗法的紧急使用授权 , 预计明年第二季度将正式提交上市申请 。
今年5月 , 礼来与君实达成合作 , 共同开发的新冠病毒中和抗体 , 这是全球首个在健康受试者中开展临床试验的新冠中和抗体 。 此次Bamlanivimab的临床获批或将加速JS016紧急使用的审批速度 。
然而就在礼来中和抗体获批紧急应用的同一天 , 全球被另一个好消息震动 。 辉瑞宣布 , 其开发的mRNA新冠疫苗取得了90%的有效性 。 这显然掩盖了新冠中和抗体获批的光辉 。
文章图片
单剂量给药获批
年底批量生产100万剂
礼来的新冠中和抗体获批 , FDA基于的是对465例轻度至中度新冠症状的非住院成人进行的II期临床试验结果分析而成 。
健识局获悉 , 该试验入组患者按照临床试验的频次划分 , 接受不同剂量的中和抗体治疗 。 其中 , 101例接受了700毫克 , 107例接受了2800毫克 , 101例接受了7000毫克 , 156例接受了安慰剂 。
试验结果显示:对于高风险患者 , 接受中和抗体治疗后平均发生的住院和急诊就诊比例为3% , 而接受安慰剂治疗的患者为10% 。 同时 , 在所有剂量患者中都取得了类似的治疗效果 。
这一试验结果足以证明礼来这款新冠中和抗体的临床有效性 。 不过 , FDA提醒:紧急使用只允许医务人员来操作 , 而且必须在症状发作后的10天内使用该药物 , 被批准的剂量为在60分钟内单次静脉注射700毫克 。
礼来公司预计 , 至今年底将生产多达100万剂700毫克Bamlanivimab , 并将于明年年初起在全球范围内使用 。 随着产能提高 , 从2021年第一季度起供应量将大幅增加 。
有分析人士指出 , FDA的有条件审批严格规范了bamlanivimab临床使用范围 , 同时给联合疗法设置了准入门槛 , 即不让任何临床疗效不明确的药物与之联用 。
可以作为参考的是 , 再生元的新冠中和抗体鸡尾酒疗法REGN-COV2抗体几乎与礼来的同时寻求FDA的紧急使用授权 , 但目前还未获得批准 。 REGN-COV2包含了两种中和抗体:REGN10933和REGN10987 。
联合疗法似乎不被FDA看好 , 不过礼来并未放弃 。 根据礼来公布的Bamlanivimab和JS016联合疗法信息显示 , 目前I期临床试验已顺利完成 。 研究数据显示 , 联用的安全性和耐受性良好 。
JS016也在寻求单用获批的可能 。 近期 , 复旦大学附属华山医院张菁向媒体透露 , 礼来和君实正在中国和周边国家开展JS016治疗新冠肺炎患者的Ib/II期研究 。
礼来方面表示 , 公司在第三季度投入了1.25亿美元 , 加速新冠中和抗体联合疗法的研发 , 预计最早将在明年第2季度取得数据并提交联合疗法的上市申请 。
- 好书|无需助力直接领!实用好书一套 8 本,带你快速提高临床技能!
- 助推|开展临床查房 助推医院发展
- 疫苗|别把希望都寄托在疫苗上?新冠病毒张文宏最新说
- 新冠疫苗|新冠疫苗之王诞生?有效性94%,明年生产10亿剂!周期资产狂飙
- 小布|集纳700万条电子病历数据,复旦儿科“AI医生”进入临床应用
- 英国_社会|英国55岁男子靠献血浆出圈,是英国新冠康复者中捐献血浆次数最多的人
- 新冠肺炎,遂宁市第一人民医院|疫情来袭时 这位医生第一个走进所在医院的隔离病区丨致敬蜀地英雄
- 谢韵宁|2020年11月17日广东省新冠肺炎疫情情况
- 病例|疫情发布丨北京11月16日无新增报告新冠肺炎确诊病例,治愈出院1例
- 鲍里斯·约翰逊|得过新冠还会二次感染吗?英国首相因密切接触患者开始自我隔离
